Determinarea experimentală a constantei Rydberg. Constanta Rydberg Care este semnificația fizică a constantei Rydberg
(R
constantă fizică (vezi constantele fizice) ,
introdus de I. Rydberg în 1890 în timp ce studia spectrele atomilor. R.p. este inclus în expresiile pentru nivelurile de energie (vezi Nivelurile de energie) și frecvențele radiațiilor atomice (vezi seria Spectral). Dacă acceptăm că masa nucleului atomic este infinit de mare în comparație cu masa electronului (nucleul este nemișcat), atunci, conform calculelor mecanice cuantice, R ∞
=
2π 2 με 4 /ch 3= (109737,3143 ± 0,0010) cm -1(din 1974), unde eȘi m- sarcina și masa electronului; Cu- viteza luminii, h- Bara este constantă. Luând în considerare mișcarea nucleului, masa electronului este înlocuită cu masa redusă a electronului și a nucleului, apoi R i= R ∞ /(1 + m/Mi),
Unde M i - masa miezului. Pentru atomii de lumină (hidrogen H, deuteriu D, heliu 4 He), valoarea R. are valorile ( cm -1): RH = 109677,593; R D= 109707, 417; R4He = 109722,267. Lit.: Taylor B., Parker W., Langenberg D., Constante fundamentale și electrodinamică cuantică, trad. din engleză, M., 1972.
- - , numărul elementelor structurale în unități. Un numar de...
Enciclopedie fizică
- - una dintre constantele fizice fundamentale; egal cu raportul dintre constanta gazului R și constanta Avogadro NA, notat cu k; numit după austriac fizicianul L. Boltzmann...
Enciclopedie fizică
- - caracterizează magnetul. rotirea planului de polarizare a luminii din obiect. Numit după francezi. matematicianul M. Verde, care a studiat cel mai deplin legile magnetismului. rotație...
Enciclopedie fizică
- - numărul de particule într-un mol de substanță. Este desemnat NA și este egal cu (6,022045...
Enciclopedie chimică
- - fizica fundamentala o constantă egală cu raportul dintre constanta gazului R și constanta Avogadro NA ...
Enciclopedie chimică
- - fizică constanta k, egală cu raportul universalului. constanta de gaz R la numărul Avogadro NA: k = R/NA = 1,3807 x 10-23 J/K. Numit după L. Boltzmann...
- - numarul de molecule sau atomi dintr-un mol de substanta; NA=6,022-1023 mol-1. Numit după A. Avogadro...
Enciclopedie modernă
- - numărul de molecule sau atomi într-un mol de substanță, NА = 6,022045 x 1023 mol-1; Nume pe nume A. Avogadro...
Științele naturii. Dicţionar enciclopedic
- - caracterizează rotaţia planului de polarizare a luminii într-o substanţă sub influenţa unui magnet. câmpuri. Unghiul de rotație f al planului de polarizare a luminii"...
Științele naturii. Dicţionar enciclopedic
- - Unul dintre principalii unnvers. fizic constante, egale cu raportul universalului...
Big Enciclopedic Polytechnic Dictionary
- - una dintre constantele fizice de bază, egală cu raportul dintre constanta universală a gazelor R și numărul Avogadro NA. : k = R/NA. Numit după L. Boltzmann...
- - introdus de I. Rydberg în 1890 în timp ce studia spectrele atomilor. R.p. este inclus în expresiile pentru nivelurile de energie și frecvențele radiațiilor atomice...
Marea Enciclopedie Sovietică
- - constanta fizică k, egală cu raportul dintre constanta universală a gazelor R și numărul Avogadro NA: k = R/NA = 1,3807,10-23 J/K. Numit după L. Boltzmann...
- este o constantă fizică inclusă în formulele pentru nivelurile de energie și seriile spectrale de atomi: , unde, M este masa nucleului, m și e sunt masa și sarcina electronului, c este viteza luminii, h este cea a lui Planck constant...
Dicționar enciclopedic mare
- - aștepta...
Dicționar de ortografie rusă
- - constant...
Dicţionar de sinonime
„Constanta lui Rydberg” în cărți
Îngrijire constantă
Din cartea Foi de jurnal. Volumul 1 autorO preocupare constantă Comitetele noastre se întreabă deja care va fi poziţia lor după ratificarea Pactului. Unii prieteni li se poate părea că ratificarea oficială a Pactului exclude deja orice inițiativă și cooperare publică. Între timp, în realitate ar trebui să fie așa
„Pompare” constantă
Din cartea Rezultate rapide. Program de eficacitate personală de 10 zile autor Parabellum Andrei Alekseevici„Actualizare” constantă De ce vă va fi dificil să vă mențineți la nivelul actual? Pentru că acum te-am tras artificial, de părul tău, te-am ridicat deasupra munților, deasupra copacilor, astfel încât să poți vedea pădurea din spatele lor, împrejurimile, să vezi perspectiva... Sarcina ta este
„Avem paranoia constantă”
Din cartea Business Way: Yahoo! Secretele celei mai populare companii de internet din lume de Vlamis Anthony„Suntem constant paranoici”, a spus Jerry Yang unui reporter Christian Science Monitor în 1998. Acest sentiment nu a dispărut și din motive întemeiate, așa cum vom arăta mai târziu.Este greu să separăm paranoia de cultura acestei companii. Au avut-o de la bun început. Și poate că ea este aceea
Îngrijire constantă
Din cartea Gateway to the Future (colecție) autor Roerich Nikolai KonstantinoviciO preocupare constantă Comitetele noastre se întreabă deja care va fi poziţia lor după ratificarea Pactului? Unii prieteni li se poate părea că ratificarea oficială a Pactului exclude deja orice inițiativă și cooperare publică. Între timp, în realitate ar trebui să fie așa
Bucurie constantă
Din cartea Marea carte a fericirii femeilor de Blavo RuschelBucurie constantă Deodată, fără niciun motiv, experimentezi bucurie. În viața obișnuită, te bucuri dacă există un motiv pentru asta. Ai cunoscut un bărbat frumos și ești fericit pentru asta; pe neașteptate ai primit banii de care aveai nevoie și te bucuri; a cumparat o casa cu
Îngrijire constantă
Din cartea Despre eternul... autor Roerich Nikolai KonstantinoviciPreocuparea constantă Comitetele noastre se întreabă deja care va fi poziţia lor după ratificarea Pactului? Unii prieteni li se poate părea că ratificarea oficială a Pactului exclude deja orice inițiativă și cooperare publică. Între timp, în realitate ar trebui să fie așa
LUCRĂRI DE LABORATOR
DETERMINAREA CONSTANTEI RYDBERG
DUPA SPECTRULUI HIDROGENULUI ATOMIC
Scopul lucrării: familiarizarea cu modelele din spectrul hidrogenului, determinarea lungimilor de undă ale liniilor spectrale din seria Balmer, calculul constantei Rydberg.
Lucrarea folosește: monocromator, generator de spectru, redresor, tuburi spectrale, fire de conectare.
PARTEA TEORETICĂ
Spectrele de emisie ale atomilor izolați, de exemplu, atomii unui gaz monoatomic rarefiat sau vapori de metal, constau din linii spectrale individuale și sunt numite spectre de linii. Simplitatea relativă a spectrelor de linii se explică prin faptul că electronii care alcătuiesc astfel de atomi sunt sub influența doar a forțelor intra-atomice și nu suferă practic nicio perturbare de la atomii îndepărtați din jur.
Studiul spectrelor de linii arată că în aranjarea liniilor care formează spectrul se observă anumite modele: liniile nu sunt localizate aleatoriu, ci sunt grupate în serie. Acesta a fost descoperit pentru prima dată de Balmer (1885) pentru atomul de hidrogen. Modelele seriale din spectrele atomice sunt inerente nu numai atomului de hidrogen, ci și altor atomi și indică manifestarea proprietăților cuantice ale sistemelor atomice radiante. Pentru atomul de hidrogen, aceste modele pot fi exprimate folosind relația (formula Balmer generalizată)
unde λ este lungimea de undă; R este constanta Rydberg, a cărei valoare, găsită din experiment, este egală cu DIV_ADBLOCK22">
Modelele spectrale ale atomului de hidrogen sunt explicate conform teoriei lui Bohr, care se bazează pe două postulate:
a) Din numărul infinit de orbite de electroni posibile din punctul de vedere al mecanicii clasice, se realizează efectiv doar unele orbite discrete care satisfac anumite condiții cuantice.
b) Un electron situat pe una dintre aceste orbite, în ciuda faptului că se mișcă cu accelerație, nu emite unde electromagnetice.
Radiația este emisă sau absorbită sub forma unui cuantum de lumină de energie https://pandia.ru/text/78/229/images/image004_146.gif" width="85" height="24">.
Pentru a construi teoria Bohr a atomului de hidrogen, este, de asemenea, necesar să invocăm postulatul lui Planck privind caracterul discret al stărilor unui oscilator armonic, a cărui energie este https://pandia.ru/text/78/229/images/ image006_108.gif" width="53" height="19 src =>>.
 |
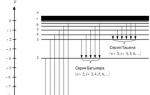
Orez. 1. Schema formării serii spectrale de hidrogen atomic.
După cum sa menționat mai devreme, postulatele lui Bohr sunt incompatibile cu fizica clasică. Și faptul că rezultatele rezultate din ele sunt în acord cu experiența, de exemplu, pentru atomul de hidrogen, indică faptul că legile fizicii clasice sunt limitate în aplicarea lor la microobiecte și necesită revizuire. Descrierea corectă a proprietăților microparticulelor este oferită de mecanica cuantică.
În conformitate cu formalismul mecanicii cuantice, comportamentul oricărei microparticule este descris de funcția de undă https://pandia.ru/text/78/229/images/image009_87.gif" width="29" height="29" > oferă valoarea densității probabilității de a găsi o unitate de volum de microparticule în apropierea unui punct cu coordonate în momentul de timp t. Acesta este sensul său fizic. Cunoscând densitatea probabilității, putem găsi probabilitatea P găsirea unei particule într-un volum finit https://pandia.ru/text/78/229/images/image012_61.gif" width="95" height="41 src=">. Pentru funcția de undă, condiția de normalizare este multumit: ![]() . Dacă starea particulei este staționară, adică nu depinde de timp (vom lua în considerare tocmai astfel de stări), atunci în funcția de undă se pot distinge doi factori independenți: .
. Dacă starea particulei este staționară, adică nu depinde de timp (vom lua în considerare tocmai astfel de stări), atunci în funcția de undă se pot distinge doi factori independenți: .
Pentru a găsi funcția de undă, utilizați așa-numita ecuație Schrödinger, care în cazul stărilor staționare are următoarea formă:
|
Unde E- plin, U este energia potențială a particulei, este operatorul Laplace. Funcția de undă trebuie să fie cu o singură valoare, continuă și finită și, de asemenea, să aibă o derivată continuă și finită. Rezolvând ecuația Schrödinger pentru un electron dintr-un atom de hidrogen, se poate obține o expresie pentru nivelurile de energie a electronilor
|
Unde n= 1, 2, 3 etc.
Constanta Rydberg poate fi găsită folosind formula (1), prin determinarea experimentală a lungimilor de undă din orice serie. Cel mai convenabil este să faceți acest lucru pentru regiunea vizibilă a spectrului, de exemplu, pentru seria Balmer ![]() , Unde i= 3, 4, 5 etc. În această lucrare, sunt determinate lungimile de undă ale primelor patru linii spectrale cele mai strălucitoare din această serie.
, Unde i= 3, 4, 5 etc. În această lucrare, sunt determinate lungimile de undă ale primelor patru linii spectrale cele mai strălucitoare din această serie.
FINALIZAREA LUCRĂRII
1. În generator spectrul prezentat în Fig. 2, puneți într-un tub spectral de neon.
2. Faceți același lucru cu tuburile de heliu și hidrogen.
3. Pentru fiecare lungime de undă, utilizați formula (1) pentru a calcula constanta Rydberg și a găsi valoarea acesteia.
4. Calculați valoarea medie a masei electronilor folosind formula.
ÎNTREBĂRI DE CONTROL
1. În ce condiții apar spectre de linii?
2. Care este modelul atomului conform teoriei Rutherford-Bohr? Prezentați postulatele lui Bohr.
3. Pe baza teoriei lui Bohr, deduceți o formulă pentru energia electronilor per n-a orbita.
4. Explicați semnificația valorii negative a energiei electronilor într-un atom.
5. Deduceți o formulă pentru constanta Rydberg pe baza teoriei lui Bohr.
6. Care sunt dificultățile teoriei lui Bohr?
7. Ce este o funcție de undă și care este semnificația ei statistică?
8. Scrieți ecuația Schrödinger pentru electronul din atomul de hidrogen. De ce numere cuantice depinde soluția acestei ecuații? Care este sensul lor?
BIBLIOGRAFIE
1., „Curs de fizică generală”, vol. 3, M., „Știință”, 1979, p. 528.
Rydbergo constant statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. Priede. priedas(ai) Grafinis formatas atitikmenys: engl. Rydberg vok constant. Rydberg Constante, f rus. constanta Rydberg, f; constanta Rydberg, f… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
constanta Rydberg- Rydbergo constant statusas T sritis fizika atitikmenys: engl. Rydberg vok constant. Rydberg Constante, f; Rydbergsche Konstante, f rus. constanta Rydberg, f pranc. constante de Rydberg, f … Fizikos terminų žodynas
constanta Rydberg- Constanta Rydberg este o valoare introdusă de Rydberg, inclusă în ecuația pentru niveluri de energie și linii spectrale. Constanta Rydberg este notată cu R. Această constantă a fost introdusă de Johannes Robert Rydberg în 1890 în timp ce studia spectre... ... Wikipedia
Structura fină constantă- Constanta de structură fină, de obicei desemnată ca, este o constantă fizică fundamentală care caracterizează puterea interacțiunii electromagnetice. A fost introdus în 1916 de către fizicianul german Arnold Sommerfeld ca măsură... ... Wikipedia
constanta lui Stefan- A nu se confunda cu constanta lui Boltzmann. Constanta lui Stefan Boltzmann (și constanta lui Stefan), o constantă fizică care este constanta de proporționalitate din legea lui Stefan Boltzmann: energia totală emisă pe unitate de suprafață... Wikipedia
RIDBERG CONSTANT- (R), o constantă fizică fundamentală inclusă în expresiile pentru nivelurile de energie și frecvențele radiațiilor atomice (vezi SERIA SPECTRALĂ); Suedeză introdusă fizicianul J.R.Rydberg (1890). Dacă presupunem că masa nucleului atomic este infinit de mare... ... Enciclopedie fizică
RIDBERG CONSTANT- (notat cu R) o constantă fizică inclusă în formulele pentru nivelurile de energie și seriile spectrale de atomi: , unde, M este masa nucleului, m și e este masa și sarcina electronului, c este viteza lumină, h este constanta lui Planck... Dicţionar enciclopedic mare
constanta Rydberg- (notat cu R), o constantă fizică inclusă în formulele pentru nivelurile de energie și seriile spectrale de atomi: R = R∞/(1 + m/M), unde R∞ = 2π2me4/ch3≈1.097373·107 m 1, M masa nucleului, m și e masa și sarcina electronului, c viteza luminii, h constantă... ... Dicţionar enciclopedic
RIDBERG CONSTANT- (notat K), fizic. constantă inclusă în fișierele pentru niveluri de energie și serii spectrale de atomi: R = Roo/(1 + m/M), unde Roo, = 2PI2me4/ch3 1,097373*107 m 1, M masa nucleară, masa și sarcina unui electron, c viteza luminii, h constanta lui Planck… … Științele naturii. Dicţionar enciclopedic
constanta Rydberg- (R este o constantă fizică (Vezi constantele fizice), introdusă de I. Rydberg în 1890 în timp ce studia spectrele atomilor. R. este inclusă în expresiile pentru nivelurile de energie (vezi Nivelurile de energie) și frecvențele radiațiilor atomice (vezi Spectral serie). Dacă…… Marea Enciclopedie Sovietică
Conform formulei empirice (501.2), constanta Rydberg poate fi determinată prin cunoașterea lungimii de undă a radiației pentru tranziția corespunzătoare.
De exemplu, în spectrul vizibil al radiațiilor (seria Balmer), un atom de hidrogen emite lumină cu lungimea de undă λ cr, corespunzătoare culorii roșii. Această primă linie vizibilă corespunde tranziției atomului de la al treilea la al doilea nivel de energie. Astfel, constanta Rydberg poate fi definită ca
A doua linie a spectrului vizibil cu lungimea de undă λ Poartă, corespunzătoare culorii albastre, apare atunci când un atom trece de la al patrulea la al doilea nivel de energie, iar constanta Rydberg este definită după cum urmează:
 . (501.13)
. (501.13)
Trecerea de la următorul (de la al cincilea) nivel de energie la al doilea este însoțită de radiații cu lungimea de undă λ sin, corespunzătoare culorii albastre, și constanta Rydberg se găsesc ca:
 . (501.14)
. (501.14)
Dacă lungimile de undă corespunzătoare sunt determinate suficient de precis, toate cele trei valori ale constantei Rydberg ar trebui să fie aceleași.
Exemplu de experiment
Scopul experimentului: Determinați valoarea constantei Rydberg.
Obiectivul experimentului: Folosind un monocromator, găsiți lungimile de undă corespunzătoare liniilor roșii, albastre și eventual albastre ale spectrului de emisie a hidrogenului atomic.
Pregătim Tabelul nr. 1 pentru datele experimentale și rezultatele prelucrării acestora.
Tabelul nr. 1. Date experimentale și rezultate ale prelucrării acestora
Privind prin ocularul monocromatorului și rotind regulatorul de lungime de undă, găsim o bandă roșie care iese în evidență clar pe fundalul general al spectrului și ne asigurăm că se află în mijlocul zonei de vizualizare. Lungimea de undă corespunzătoare (în nm) va fi afișată pe contorul monocromatorului. O scriem în prima linie a tabelului nr. 1 a coloanei „Lungime de undă”, transformând valoarea în metri.
Într-un mod similar, încercăm să găsim liniile albastre și albastre în spectru și să notăm valorile lungimilor de undă ale acestora în metri în tabelul nr. 1.
Folosind formulele (501.12), (501.13) și (501.14), calculăm valorile constantei Rydberg și le scriem în celulele corespunzătoare din tabelul nr. 1 (în m -1).
Calculăm media aritmetică a constantei Rydberg
 . (501.15)
. (501.15)
Găsim eroarea absolută rădăcină medie pătrată în determinarea constantei Rydberg:
 . (501.16)
. (501.16)
unde 4,3 este coeficientul Student pentru trei măsurători cu o probabilitate de încredere de P = 0,95
Notăm rezultatul final:
 m -1.
m -1.
Verificarea rezultatelor
Diferența relativă dintre valoarea teoretică a constantei Rydberg, calculată folosind formula (501.3), și valoarea sa medie experimentală nu trebuie să depășească 10%:
 . (501.17)
. (501.17)
Dacă da, atunci experimentul a avut succes.
ÎNTREBĂRI PENTRU PREGĂTIREA EXAMENULUI DE FIZICĂ CURS II, PARTEA 3
Valuri în medii elastice. Unde longitudinale și transversale Ecuația unei unde armonice care se deplasează, graficul acesteia, viteza de fază, lungimea de undă, numărul de undă (1.1, 1.3).
Frontul de undă, suprafețele de undă, viteza de fază, ecuația de undă (1.3, 1.4).
Principiul suprapunerii undelor. Viteza grupului. Energia valurilor de călătorie. Vectorul densității fluxului de energie este vectorul Umov (1.5, 1.6).
Undele electromagnetice. Ecuații de unde. Ecuația unei unde armonice plane (2, 2.1, 2.2).
Energia undelor electromagnetice. Flux de energie. Vectorul densității fluxului de energie este vectorul Poynting (2.3).
Radiația de la un dipol electric. Scara undelor electromagnetice (2.4, 2.5).
Interferența luminii. Monocromaticitatea și coerența undelor. Calculul interferenței a două unde (3.1.1 – 3.1.3).
Metode de obținere a undelor coerente (3.2).
Lungimea căii optice și diferența de cale optică (3.3).
Interferența luminii în peliculele subțiri. Optica iluminatoare. Interferometre (3.4, 3.5).
Difracția luminii. Principiul Huygens-Fresnel. Metoda zonei Fresnel (4.1, 4.2).
Difracția Fresnel printr-o gaură rotundă și un disc (4.3).
Difracția Fraunhofer la o singură fantă (4.4).
Rețeaua de difracție (4.5).
Difracția printr-o rețea spațială. Formula Wulf-Bragg (4.6).
Rezoluția instrumentelor optice. Conceptul de holografie (4.7, 4.8).
Interacțiunea luminii cu materia. Absorbția luminii. legea lui Bouguer. Răspândirea luminii. legea lui Rayleigh (6.1 – 6.3).
Dispersia luminii. Dispersia electronică a luminii. Dispersie normală și anormală (6.4).
Polarizarea luminii. Lumina naturala si polarizata. legea lui Malus (6.5).
Polarizarea luminii în timpul reflexiei și refracției. legea lui Brewster (6.6).
Birefringență. Anizotropie optică artificială. Rotația planului de polarizare (6.7, 6.8).
Radiație termala. Caracteristicile radiațiilor termice. Corp absolut negru. legea lui Kirchhoff (7.1 – 7.3).
Distribuția energiei în spectrul unui corp complet negru. Stefan-Boltzmann și legile Wien (7,4 – 7,6).
Formula Rayleigh-Jeans. „Dezastru ultraviolet” Ipoteza lui Planck. Formula lui Planck. Relația dintre formula lui Planck și legile Stefan-Boltzmann și Wien (7.7).
Foton. Energia, masa și impulsul unui foton. Presiune ușoară (8.1, 8.2).
Efect foto. Ecuația lui Einstein pentru efectul fotoelectric extern (8.3).
Efectul Compton. Dualitatea undă-particulă a radiației electromagnetice (8.4, 8.5).
Ipoteza lui De Broglie. Fundamentarea experimentală a dualismului undă-particulă al materiei. Experiment Davisson-Germer (9.1).
Relația de incertitudine Heisenberg. Imposibilitatea precizării clasice a stării microparticulelor (9.2).
Funcția de undă și semnificația ei statistică (9.3).
Ecuația Schrödinger pentru stări staționare. Funcții proprii și valori proprii. Particulă liberă (9,4, 9,5).
Particulă într-un „puț de potențial” dreptunghiular unidimensional (9.6).
Oscilatoare clasice și cuantice (9.7).
Modelul atomic al lui Rutherford (11.1).
postulatele lui Bohr (11.2).
Spectrul de linii al unui atom de hidrogen (11.3).
Atom de hidrogen conform mecanicii cuantice. Numerele cuantice ale unui electron dintr-un atom (11.4).
Principiul Pauli (11.5).
Absorbție, emisie spectrală și stimulată (12.1).
Principiul funcționării laserului (12.2).
Această constantă a apărut inițial ca un parametru de potrivire empiric în formula Rydberg care descrie seria spectrală a hidrogenului. Niels Bohr a arătat mai târziu că valoarea sa poate fi calculată din mai multe constante fundamentale, explicând relația lor folosind modelul său al atomului (modelul Bohr). Constanta Rydberg este valoarea limită a celui mai mare număr de undă al oricărui foton care poate fi emis de un atom de hidrogen; pe de altă parte, este numărul de undă al fotonului cu cea mai mică energie capabil să ionizeze un atom de hidrogen în starea sa fundamentală.
Este folosită și o unitate de energie strâns legată de constanta Rydberg, numită simplu Rydberg si desemnat R y (\displaystyle \mathrm (Ry) ). Ea corespunde energiei unui foton al cărui număr de undă este egal cu constanta Rydberg, adică energia de ionizare a atomului de hidrogen.
Din 2012, constanta Rydberg și factorul g al electronului sunt constantele fizice fundamentale măsurate cu cea mai mare precizie.
Valoare numerică
R (\displaystyle R)= 10973731,568508(65) m−1.Pentru atomii de lumină, constanta Rydberg are următoarele valori:
R y = 13,605 693009 (84) (\displaystyle \mathrm (Ry) =13(,)605693009(84)) eV = 2,179 872325 (27) × 10 − 18 (\displaystyle 2(,)179872325(27)\times 10^(-18)) J.Proprietăți
Constanta Rydberg intră în legea generală pentru frecvențele spectrale după cum urmează:
ν = R Z 2 (1 n 2 - 1 m 2) (\displaystyle \nu =R(Z^(2))\left((\frac (1)(n^(2)))-(\frac (1) )(m^(2)))\dreapta))Unde ν (\displaystyle \nu )- numărul de undă (prin definiție, aceasta este lungimea de undă inversă sau numărul de lungimi de undă pe 1 cm), Z - numărul de serie al atomului.
ν = 1 λ (\displaystyle \nu =(\frac (1)(\lambda ))) cm−1În consecință, este îndeplinită
1 λ = R Z 2 (1 n 2 − 1 m 2) (\displaystyle (\frac (1)(\lambda ))=R(Z^(2))\left((\frac (1)(n^( 2)))-(\frac (1)(m^(2)))\dreapta)) R c = 3,289 841960355 (19) × 10 15 (\displaystyle R_(c)=3(,)289841960355(19)\times 10^(15)) s -1De obicei, când se vorbește despre constanta Rydberg, se referă la constanta calculată pentru un nucleu staționar. Luând în considerare mișcarea nucleului, masa electronului este înlocuită cu masa redusă a electronului și a nucleului, apoi
R i = R 1 + m / M i (\displaystyle R_(i)=(\frac (R)(1+m/M_(i)))), Unde M i (\displaystyle M_(i))- masa nucleului atomic.